Принцип рада батерије
Како функционишу зидни сат, даљински управљач за ТВ или дечија играчка са радио-контролом? Већина људи ће без оклевања одговорити „на батерије“ и, у принципу, биће у праву. Али тешко да ће неко од њих моћи да каже како се тачно преносива батерија утростручила, како функционише и без чега би био немогућ читав процес преношења електричне струје од батерије до крајњег потрошача. Хајде да попунимо ову досадну празнину у знању.
Принцип рада батерије
Да бисте разумели принцип рада конвенционалне АА батерије, морате имати опште разумевање њене структуре. Дакле, свака батерија се састоји од три главна елемента - аноде, катоде и електролита. Штавише, ово последње може имати практично било које стање агрегације: катода и анода смештене у физиолошки раствор, у принципу, су такође „батерија“, само у облику који је неуобичајен за просечну особу.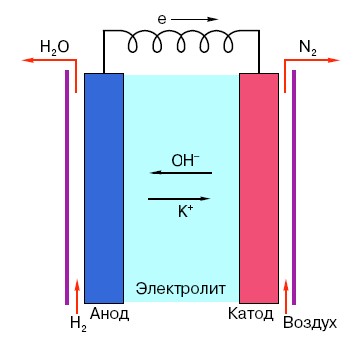
Занимљиво! Такозвани „волтаични стуб“, који је измислио Алесандро Волта, такође је имао све елементе неопходне за производњу електричне струје. Састојао се од плоча цинка и бакра наслаганих једна на другу, између којих је као „слој“ постављена тканина натопљена киселином.
Анода у таквим системима је главни извор електрона, који, као што знамо из школског курса физике, имају негативно наелектрисање.Негативно наелектрисане честице привлаче позитивне, а у овом случају површина катоде делује као „плус“.
Али то није довољно да се појави електрична струја, јер електронима је потребна и нека врста „аутопута“ - медијума који би подржао интеракцију катоде и аноде. Овде се "на сцени" појављује електролит - со, алкалија или киселина способна да спроведе струју.
Хајде да погледамо принцип рада на конкретном примеру: постоји батерија од 18 волти. Напон између електрода у њему је стабилан док се не повеже на мрежу. Чим се појави потрошач (на пример, обична сијалица), напон почиње да се постепено смањује, струја почиње да тече од „негативне” електроде до „позитивне” и долази до хемијске реакције у електролиту усмерене на одржавање разлике потенцијала између електрода.
Референца. Што је више енергије потребно потрошачу, то је реакција унутар батерије интензивнија и она ће брже пропасти.
Како функционише пуњива батерија, како се разликује од обичне
Дакле, погледали смо класичне „прст” и „мали прст” батерије и знамо да је животни век већине њих стриктно ограничен (ма шта рекли познати произвођачи). Али шта је са такозваним батеријама - батеријама типа батерија које не само да могу да троше енергију током процеса реакције, већ је и акумулирају и чувају дуго времена?
Да бисте разумели принцип рада батерије, потребно је обратити се хемији. Узмимо за пример... Обична ватра на ћумур.Без обзира колико лепо и фасцинантно изгледа пламен, сваки хемичар који га посматра зна да је овај процес само дуготрајна реакција оксидације горива. Сагоревање угља је у интеракцији са кисеоником и као резултат ове реакције добијамо:
- угљен диоксид;
- светлост;
- топло.
А ако су последње две тачке способне да загреју душу и тело, онда ни на који начин не можемо користити угљен-диоксид, јер је он нуспроизвод реакције, који је, у ствари, њен отпад. Реакција оксидације престаје када понестане почетних елемената: кисеоника и угља. Заустављање реакције у батерији се дешава на потпуно исти начин када су почетне супстанце потпуно исцрпљене и остаје само "отпад".
У батерији се све дешава мало другачије. Чињеница је да реакција која се дешава у њему спада у категорију реверзибилних, односно под одређеним условима може се "обрнути", враћајући све супстанце у првобитно стање. То је могућност реверзибилне реакције која се јавља у батерији која омогућава њено пуњење.
У батерији спојеној на мрежу, реакција се одвија у супротном смеру, а струја тече од „плус“ до „минус“, а не обрнуто. Као резултат, производ реакције формира почетне супстанце, а власник батерије добија доступну „опорављену“ енергију у преносивом формату. То је све!





